Механизмы старения
Механизмы старения
Физиологические механизмы старения
Мозг животных и человека, нервная система играют главную роль в старении. С возрастом нервная ткань подвергается износу на всех уровнях организации: структурном, биохимическом и функциональном.
Структурные изменения проявляются в значительной утрате количества нейронов в базальных ганглиях, мозжечке и спинном мозге. В головном мозге изменения затрагивают только небольшую часть нейронов.
Научно доказанным фактом в механизме старения является роль гипоталамуса. У человека с возрастом в гипоталамусе снижается концентрация норадреналина и ДОФА-декарбоксилазы, в то время как концентрация моноаминооксидазы и ацетихолинэстеразы увеличивается.
Старение сопровождается также снижением количества воды в мозговой ткани и изменением сосудистой циркуляции в мозге. В клетках нервной системы меняется состав липидов, усиливается активность свободно-радикальных процессов, накапливаются мутации ДНК, снижается синтез белков.
Самым значимым функциональным изменением нервной системы у старых людей является заторможенность поведения. Это проявляется не только в двигательных реакциях, но и при сложных процессах усвоения информации, которые ассоциируются с краткосрочной памятью.
Нарушения сна касаются фаз глубокого сна. От состояния центральной нервной системы (ЦНС) зависит также и осанка. Снижение функциональной активности вегетативной нервной системы проявляется в форме гипотонии, нарушении терморегуляции, расстройства желудочно-кишечного тракта и недержания мочи. В старости активность симпатической нервной системы повышается, что может влиять на познавательные функции.
Иммунологические механизмы старения
Иммунная система тесно связана с системой гемопоэза (системой кроветворения). Они обе имеют единое происхождение от общих поливалентных стволовых клеток, которые содержатся в костном мозге. Эти системы играют ключевую роль в защите организма, предупреждении опухолей (иммунный надзор) и возникновении ответа на инфекционные агенты.
Оказывается, что с возрастом основной гемопоэз у животных и человека не изменяется. Правда, резервные возможности этой системы могут сужаться, что и приводит к снижению способности реагировать на стрессовые воздействия.
Периферические лимфоидные органы, такие как селезенка и лимфоузлы, с возрастом не претерпевают изменений в размерах. Продукция стволовых клеток хорошо сохраняется в зрелом возрасте. Обмен цинка, который играет существенную роль в иммунокомпетенции, в старости снижается. Поэтому очень важно включать в свой рацион достаточное количество продуктов, содержащих цинк (пшеничные отруби, печень телячья жареная, угри вареные, говядина, дрожжи, кедровые орехи, сыр пармезан, желток яичный, анчоусы, куриное мясо, молоко цельное). Иммунная и нервная системы связаны через эндокринную систему. Это взаимодействие осуществляется главным образом циркуляцией гуморальных факторов посредством эпифизарногипоталамо-гипофизарной системы.
Гормоны и нейромедиаторы достигают лимфоидных органов через кровь или прямые связи с вегетативной нервной системой. Установлено, что некоторые иммуномодуляторы, в частности витамин Е, калорийно ограниченная диета и физические упражнения, вакцины, пептидные препараты тимуса могут восстанавливать компетентность иммунных клеток в стареющем организме и увеличивать продолжительность жизни.
Гипофиз продуцирует гормон роста, который стимулирует обмен жирных кислот, синтез ДНК, РНК и белков, участвует в регуляции деления клеток. С возрастом ночной пик секреции гормона роста снижается.
Гипоталамус регулирует секрецию гормона роста двумя гормонами, один из которых вызывает его секрецию, а другой угнетает. Гормон роста стимулирует пролиферацию эндотелиальных клеток сосудистой стенки, образование трубок и ангиогенез в целом. Снижение его продукции с возрастом является существенным фактором сосудистой недостаточности.
Старение гипоталамуса затрагивает и такой важный регуляторный механизм, как контроль потребления пищи, то есть центры аппетита и насыщения, находящиеся в гомеостатических отношениях с другими компонентами системы регуляции обмена энергии в организме.
Нейроэндокринологическая теория старения
Существует нейроэндокринологическая (элевационная) теория старения, согласно которой с возрастом происходит повышение порога чувствительности гипоталамуса к гомеостатическим сигналам.
Следствием такого возрастного изменения является нарастание содержания жира в теле, снижение чувствительности тканей к инсулину (предиабет) и развитие атеросклероза.
В. М. Дильман считал, что старение не запрограммировано, а является побочным продуктом генетической программы развития, и поэтому старение возникает с закономерностью, свойственной генетической программе.
Из онтогенетической модели возникновения болезней следует, что их развитие можно затормозить, если стабилизировать состояние гомеостаза на уровне, достигаемом к окончанию развития организма, то есть к 20–25 годам. Если замедлить скорость старения, то можно увеличить продолжительность жизни человека.
Какие болезни являются главными, приводящими к смерти человека? Это болезни сердца, злокачественные новообразования, цереброваскулярная патология, метаболическая иммунодепрессия, атеросклероз, сахарный диабет и ожирение, психическая депрессия, аутоиммунные заболевания, гиперадаптоз и др.
Многие эти заболевания связаны с возрастными изменениями в гипоталамо-гипофизо-надпочечниковой системе, которая обеспечивает тонический уровень глюкокортикоидных гормонов в крови, их циркадный ритм. При стрессе происходит повышение содержания этих гормонов, которые способствуют увеличению концентрации глюкозы в крови. С возрастом происходит выброс этих гормонов неадекватно уровню таких гомеостатических сигналов, как, например, стресс. Развиваются такие состояния, как гиперадаптоз, метаболическая иммунодепрессия, гипергликемия, которые в дальнейшем приводят к вышеуказанным заболеваниям.
Имеется еще одно опасное для организма состояние – это гиперинсулинемия. Оно развивается независимо от гипергликемии в связи с нарушенной способностью инсулина стимулировать метаболизм глюкозы в скелетных мышцах. Организм как бы становится нечувствителен к инсулину (резистентен к инсулину). Гиперинсулинемия способствует окислительному стрессу и тем самым ускоряет старение и формирует такие заболевания, как сахарный диабет, атеросклероз, гипертоническую болезнь и рак. Современная медицина использует миметики калорийно-ограниченной диеты, которые повышают чувствительность к инсулину и снижают уровень глюкозы в организме. Это направление в геронтологии является весьма перспективным.
Эпифиз и механизмы старения
Эпифиз, или шишковидная железа, расположена в головном мозге и выполняет в организме ключевую роль как ритмоводитель многих его функций.
Эпифиз имеет размер с горошину и находится в глубине мозга. Древние индусы называли эту железу «третьим глазом». Она содержит пигментные клетки, подобные тем, что находятся в глазах. Они светочувствительны и реагируют на периоды света и темноты, воздействующие на них через глаза. Эпифиз вырабатывает и секретирует в кровь гормон мелатонин. Выделение гормона носит циркадный характер, то есть зависит от времени суток: свет угнетает продукцию и секрецию мелатонина, а в ночные часы его содержание в эпифизе и крови максимальное. Таким образом, эпифиз можно считать солнечными часами нашего организма, только со знаком минус: чем больше световой день, тем меньше мелатонина.
Циркадный ритм весьма важен не только для временной организации физиологических функций организма, но и для продолжительности его жизни. Уровень мелатонина достигает своего пика в детском организме, авюности начинает постепенно уменьшаться. Мелатонин и его пептидный экстракт эпиталамин угнетают свободнорадикальные процессы, стимулируют клетки иммунной системы и замедляют ее старение, нормализуют жироуглеводный обмен, обладают антиканцерогенным эффектом. В этом проявляется его геропротекторное действие. Это действие выражается в нормализации функций органов, которые нарушены в результате генетических дефектов или старения.
Мелатонин регулирует циклы жизнедеятельности человека: сон и бодрствование, адаптацию к переменам погоды, смене времен года и часовых поясов. Мелатонин является универсальным естественным адаптогеном. Кроме этого, он:
• укрепляет иммунную систему;
• повышает сопротивляемость организма раку и другим заболеваниям;
• продлевает период сексуальной активности;
• понижает кровяное давление и нормализует уровень холестерина;
• облегчает борьбу со стрессом;
• является естественным снотворным.
Старение и биологический возраст
Здоровье человека, продолжительность его жизни тесно связаны с характером старения организма.
Биологическое старение – это процесс изменения организма человека во времени. Старение вызывает постепенное угасание приспособительных возможностей организма, уменьшение резервных возможностей его систем. Понимание процессов, которые происходят во время старения человека, имеет важное практическое значение. Знание этих процессов дает возможность управлять ими, замедлять старение и увеличивать продолжительность жизни каждого человека.
Морфологические и функциональные изменения, которые происходят по мере старения в организме человека, имеют существенные индивидуальные различия.
Причины этих различий процесса старения людей одного и того же возраста (календарного) определяются совокупностью факторов. К этим факторам относятся:
• особенности генетического аппарата (наследственные факторы);
• особенности гомеостаза и нейроэндокринной регуляции, которые обеспечивают активность центральной нервной системы, сердечно-сосудистой, дыхательной, иммунной систем;
• образ жизни;
• физическая активность;
• характер питания;
• вредные привычки;
• стрессы;
• подверженность болезням;
• условия окружающей среды и др.
Различают естественное (физиологическое) старение и преждевременное старение.
Физиологическое старение – естественное начало и постепенное развитие старческих изменений, которые ограничивают способность организма адаптироваться к окружающей среде. Биологический возраст (БВ) таких людей соответствует их календарному возрасту (КВ).
Преждевременное старение – ускорение темпа старения, приводящее к тому, что данное лицо опережает средний уровень старения своей возрастной группы. При преждевременном старении возрастные изменения наступают раньше, чем у здоровых людей соответствующего возраста. Его можно определить как разность между биологическим и календарным возрастом человека, при этом БВ опережает его КВ (рис. 1).
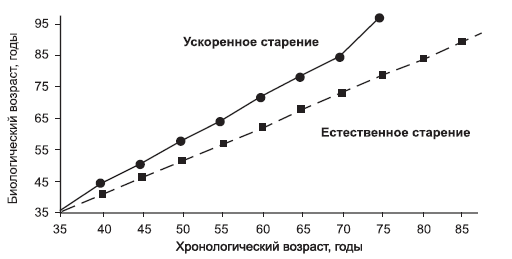
Рис. 1. Преждевременное старение
Люди, ведущий здоровый образ жизни, могут иметь БВ меньше, чем КВ, в результате на каждый хронологический год приходится укороченный биологический год (рис. 2). В таких случаях можно говорить о замедленном старении.
К сожалению, преждевременное старение в нашей стране является наиболее частой формой старения человека и становится причиной сокращения продолжительности жизни населения.
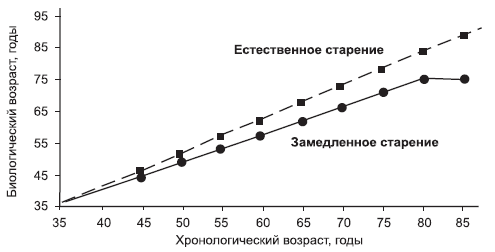
Рис. 2. Замедленное старение
Почему это происходит? Какие факторы являются причиной преждевременного старения? К ним в первую очередь относятся:
• гиподинамия;
• длительные и часто повторяющиеся нервно-эмоциональные перенапряжения (дистресс);
• несбалансированное питание;
• хронические заболевания;
• вредные привычки;
• различные интоксикации;
• отягощенная наследственность.
Люди, ведущие здоровый образ жизни, могут иметь БВ меньше, чем их КВ, то есть у них замедляется процесс старения, и такие люди выглядят моложе своих лет.
Современная наука ставит перед собой задачу разработать такие методы профилактики старения, которые бы снизили скорость биологического старения до 0 (рис. 3). Именно это является мечтой всего человечества: не стареть и оставаться вечно молодым!
Пока, видимо, это возможно только теоретически. Но разработка таких программ уже ведется, и основная их цель – предупреждение старения, управление процессами старения и не просто увеличение продолжительности жизни, но улучшение ее качества.
Для достижения этой цели понадобится научиться управлять процессами онтогенеза, то есть процессами индивидуального развития.
Откуда начинается отсчет времени, с которого в организме человека наступают необратимые изменения, которые и приводят в конце концов к старости. И насколько этот процесс необратим и неумолим?
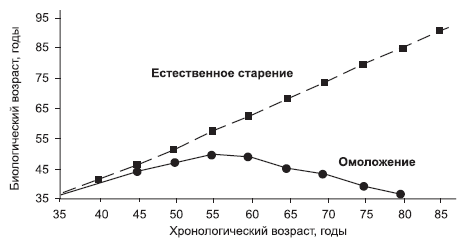
Рис. 3. Оптимальная программа замедления старения
К 20–25 годам заканчивается рост организма. Именно в этом возрасте у человека устанавливаются оптимальные характеристики гомеостатических систем организма. Это расцвет жизни человека, и этого же момента начинается путь к возрастной патологии и старости.
Поскольку каждый человек уникален, то и норма его биологического старения может быть только строго индивидуальна. В клинической практике существует понятие идеализированной «единой нормы» – величины характеристик состояния гомеостатических систем организма в возрасте 20–25 лет. Любое стойкое отклонение от индивидуальной нормы молодого возраста – это путь к болезням и старению. При таком подходе, если функциональные и резервные возможности организма в возрасте 20–25 лет взять за 100 %, то их изменение в зависимости от КВ можно представить в виде графика (рис. 4).
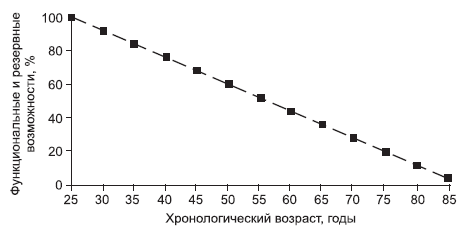
Рис. 4. Естественный процесс старения
В случае наличия у человека вредных привычек, частых заболеваний, он будет стареть ускоренно, так как его функциональные и резервные возможности будут уменьшаться с большей скоростью. Каждый эпизод болезни приводит к снижению этих возможностей и ускоренному старению (рис. 5).
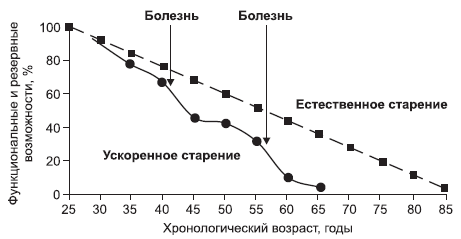
Рис. 5. Ускоренное старение
Разработка и практическая реализация программы предупреждения старения в случае ее эффективности будет сопровождаться более медленным снижением функциональных и резервных возможностей организма (рис. 6).
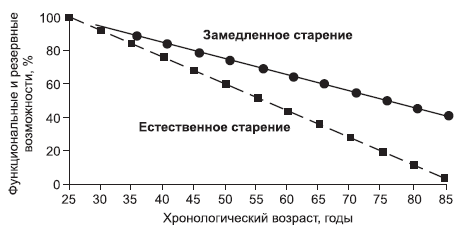
Рис. 6. Замедленное старение
Старение характеризуется изменениями ряда физиологических показателей организма. Если принять эти наиболее типичные показатели в 30 лет за 100 %, то в пожилом возрасте они будут снижаться так:
• 5 % – скорость проведения нервных импульсов;
• 18 % – уровень основного обмена;
• 20 % – содержание воды в организме;
• 30 % – сердечный выброс;
• 32 % – скорость клубочковой фильтрации;
• 50 % – почечный кровоток;
• 60 % – максимальная емкость легких;
• 63 % – максимальное потребление кислорода;
• 45 % – масса мозга.
Эти снижения резервных возможностей организма варьируют у разных людей в зависимости от их способности к адаптации к внутренним и внешним стрессорным факторам. Если при стрессе происходит срыв адаптационных возможностей, то это приводит к тому или иному заболеванию.
С увеличением возраста многие органы уменьшаются в размерах. Так, потеря ткани тимуса ограничивает функцию иммунной защиты в старости. Ряд других возрастных явлений связан с регуляторными нарушениями. Так, при менопаузе изменения в уровне гормонов ускоряют процесс старения.
Исследования показали, что регуляторные изменения, которые генетически связаны со старением, реализуются через ось гипоталамус – гипофиз – щитовидная железа.
По мере взросления человека его органы и системы подвергаются указанным выше изменениям, но ни одно из них не относится к летальным. Сам по себе процесс старения никогда не приводит к смерти, она наступает в результате какой-либо болезни, связанной с этим нарушением. Все эти процессы у разных людей протекают с биологически разной скоростью.
Старение в рамках онтогенетической модели обусловлено возрастным процессом повышения порогом чувствительности гипоталамуса к регуляторным влияниям и, как следствие, развитием неизбежных нарушений в энергетическом, адаптационном и репродуктивном гомеостазе.
Именно гипоталамические сдвиги приводят эти системы гомеостаза к перенапряжению и формированию старения и связанных с ним болезней. Можно сказать, что старение – это суммарное воздействие во времени на регуляторную функцию гипоталамуса. Поддержание и сохранение ритма функционирования главных гомеостатических систем организма – вот главная задача, чтобы предотвратить старение.
Гипоталамус и его связь с главными системами организма
Необходимым условием жизни организма является постоянство его внутренней среды, которое поддерживается согласованным функционированием нервной, эндокринной и иммунной систем. Такое состояние равновесия и гармонии получило название гомеостаз.
Центральным звеном, обеспечивающим взаимодействие этих систем, являются гормоны.
Гормоны – группа соединений, отличающихся по химической структуре и физико-химическим свойствам. Их можно разбить на 4 группы.
1. Гормоны белковой природы (гормоны гипофиза, гипоталамуса, поджелудочной железы и др.).
2. Гормоны – производные аминокислот (адреналин, тироксин, трийодтиронин).
3. Гормоны – производные жирных кислот (простагландины).
4. Стероидные гормоны – производные холестерина (женские и мужские половые гормоны, гормоны коры надпочечников).
Большинство гормонов, относящихся к трем первым группам, действуют быстро, мгновенно, изменяя один или несколько метаболических процессов.
Действие стероидных гормонов является более кардинальным – оно проявляется на уровне генома, стимулируя синтез специфических РНК и белков.
Для гормонов характерна определенная специфичность по отношению к клеткам: каждый из них действует только на определенные типы клеток – клетки-мишени. Гормоны доставляются к месту расположения клеток-мишеней плазмой крови либо в свободном виде, либо связанными с белком.
Под действием гормонов происходит активация процессов фосфорилирования различных белков и синтеза РНК. Синтез и секреция гормонов регулируются нервной системой либо непосредственно, либо через выделение других гормонов.
Регуляторные центры образованы ганглиозными (нервными) клетками определенных зон ЦНС. Регуляция, осуществляемая с помощью периферической и центральной нервной системами, целенаправленная, быстрая, но она не охватывает все клетки организма. А это необходимо для сохранения гомеостаза.
Поэтому нервная регуляция дополняется регуляцией, основанной на действии гормонов.
Местом, в котором оба вида регуляции смыкаются и функционально дополняют друг друга, являются ганглиозные клетки гипоталамуса.
Сигналы из различных отделов мозга, прежде всего, поступают в гипоталамус, где фильтруются и необходимая информация в виде специфических гормонов направляется к клеткам желез внутренней секреции.
В организме человека в нормальных условиях многие функции осуществляются автоматически без участия ЦНС благодаря деятельности гипоталамуса. При изменении состояния внешней или внутренней среды ЦНС получает информацию из органов чувств, и этот сигнал передается в гипоталамус, который в свою очередь посылает сигналы в гипофиз. Гипофиз секретирует специфические гормоны, которые выделяются в кровь и поступают в соответствующие железы внутренней секреции.
Эндокринная система человека состоит из следующих желез:
• гипоталамус;
• гипофиз;
• эпифиз;
• щитовидная железа;
• паращитовидные железы;
• поджелудочная железа;
• кора и мозговой слой надпочечников;
• половые железы.
Кроме эндокринной системы имеется экзокринная система, которая продуцирует гормоны, поступающие не в кровоток, а в те ткани, где они синтезируются. К экзокринной системе относятся следующие органы и клетки:
• плацента;
• определенные клетки желудочно-кишечного тракта (гастрин и др.);
• клетки мозга, миокарда, жировые клетки;
• опиатные пептиды – эндорфины и кефалины в мозге и гипофизе.
Гипоталамус является высшим центром эндокринных функций. Он контролирует и интегрирует все висцеральные функции организма и объединяет эндокринные механизмы регуляции с нервными. Этим обусловлено его значение как мозгового центра симпатического и парасимпатического отделов вегетативной нервной системы.
Крупные нейросекреторные клетки гипоталамуса продуцируют нейрогормоны – вазопрессин, или антидиуретический гормон (АДГ), и окситоцин, которые по аксонам этих клеток поступают в заднюю долю гипофиза, откуда разносятся кровью.
Мелкие нейросекреторные клетки гипоталамуса вырабатывают аденогипофизотропные нейрогормоны, так называемые рилизинг-гормоны, с помощью которых гипоталамус контролирует синтез гормонов гипофиза.
Гипоталамус играет ведущую роль в поддержании оптимального уровня обмена веществ и энергии, в регуляции теплового баланса организма, функций пищеварительной, сердечно-сосудистой, выделительной, дыхательной и эндокринной систем. Можно сказать, что гипоталамус является вегетативным мозгом человека. А поскольку эмоции также «проходят» через гипоталамус, то он является и «эмоциональным» мозгом.
Таким образом осуществляется единство нервной и гуморальной регуляции в организме.
Стресс и старение
Стрессом, по определению Г. Селье, называется совокупность защитных реакций, которые возникают в ответ на изменение условий внешней или внутренней среды. Эти реакции являются адаптационными, или приспособительными, направленными на повышение работоспособности организма.
В своем развитии стресс проходит три стадии.
1. Тревога.
2. Резистентность.
3. Истощение.
Первая стадия развивается примерно через шесть часов после стрессорного воздействия. За это время происходит мобилизация защитных сил организма, главным образом, активация симпатико-адреналовой системы.
Эта стадия при благоприятных условиях в течение 1–2 суток переходит в стадию резистентности, или устойчивости.
Если стрессорное воздействие продолжается или оказывается слишком сильным, а резервные возможности организма сниженными, развивается стадия истощения.
В адаптационных реакциях на стрессорное воздействие (стресс) участвуют все системы организма.
ЦНС организует поведение в новых условиях. Ткани, органы, клетки реагируют на повреждающий фактор с помощью механизмов регуляции на молекулярном, клеточном и нейрогуморальном уровнях.
Адаптационный ответ организма на стресс помогает восстановить гомеостаз, нарушенное равновесие организма. Если же адаптация, требующая напряжения и мобилизацию всех систем, усиливается и удлиняется по времени, то может произойти срыв адаптационных систем, и таким образом стресс вызовет нарушение гомеостаза и будет способствовать возникновению того или иного заболевания и старению организма.
При стрессе возникают те или иные эмоции (страх, гнев, обида). Они являются сильнейшими мобилизующими факторами, и именно эмоции становятся пусковым механизмом всех последующих «перестроек», которые происходят в организме в ответ на раздражитель.
Гипоталамус является мозговым центром, куда «поступают» эмоции и откуда берет начало каскад реакций, который и называется адаптационным ответом на стресс. Этот ответ реализуется активацией оси гипоталамус – гипофиз – кора надпочечников, а также симпатико-адреналовой системы, в результате чего повышается синтез глюкокортикоидов и катехоламинов (адреналина и норадреналина). Как это происходит?
В ответ на стресс нейросекреторные клетки гипоталамуса вырабатывают кортикотропин-рилизинг-гормон (КРГ), который вызывает в гипофизе синтез адренокортикотропного гормона (АКТГ). Кроме того, КРГ стимулирует центры страха и тревоги в лимбической системе и вызывает определенные поведенческие реакции. КРГ подавляет пищевое и питьевое поведение, усиливает двигательную активность.
АКТГ, который секретирует аденогипофиз в ответ на КРГ, является главным гормоном стресса. Он контролирует синтез гормонов коры надпочечников.
Кора надпочечников продуцирует гормоны, носящие название кортикостероиды. Биосинтез стероидных гормонов осуществляется из холестерина при участии множества ферментов. Конечными продуктами этого синтеза являются глюкокортикоиды (кортизол, дезоксикортизол), минералокортикоиды (альдостерон, дезоксикорти-костерон) и андрогены (андростендион и тестостерон). Женских половых гормонов – эстрона и эстрадиола – в надпочечниках образуется очень мало, но андрогены, которые они вырабатывают, служат источником эстрогенов, которые образуются в подкожной жировой клетчатке, волосяных фолликулах, молочной железе.
Глюкокортикоидам принадлежит основная роль в обеспечении длительной защитной реакции организма на стресс. Они мобилизуют образование глюкозы из аминокислот и стимулируют липолиз – расщепление триглицеридов – основу жировой ткани. Последний эффект особенно значителен в подкожной жировой клетчатке нижних конечностей и мало ощутим в абдоминальной жировой ткани. Это объясняет тот факт, что при стрессе не всегда худеют, особенно те, кто страдает абдоминальным ожирением. Мобилизация жирных кислот усиливается и прямыми нервными симпатическими влияниями, исходящими из гипоталамуса.
Длительный стресс повышает уровень липопротеинов очень низкой плотности, вызывающих атеросклероз сосудов. Кроме того, хронические стрессы приводят к увеличению секреции инсулина, который в свою очередь повышает содержание жира в организме, особенно в области шеи, живота, лица.
Другой гормон стресса – адреналин, совместно с глюгокортикоидами оказывает влияние на гемопоэз и иммунную систему.
Глюкокортикоиды и катехоламины оказывают противовоспалительные эффекты: сужение сосудов, снижение проницаемости их стенок, стимуляция антиоксидантных систем.
Стресс вызывает такую перестройку метаболизма и физиологических функций, которые резко повышают устойчивость организма к острой гибели. Для реализации этих изменений необходима мобилизация энергетических ресурсов, возрастающих при сильном стрессе за два и более раза.
Так, если на основной обмен расход энергии составляет 1500–1800 ккал, то при стрессе он может превышать 3500–3800 ккал в сутки.
Катехоламины и глюкокортикоиды усиливают:
• гликогенолиз в мышцах, сердце, печени, макрофагах;
• глюконеогенез (гликогенолиз и глюконеогенез увеличивают содержание глюкозы в крови);
• липолиз – увеличение жирных кислот;
• гипервентиляцию – увеличение доступности субстратов окисления, потребления кислорода;
• активность ферментов перекисного окисления липидов;
• транспорт кальция в клетки – главного активатора физиологических функций.
Превращение стресса из звена адаптации в патологию происходит вследствие чрезмерной активации перечисленных состояний, которые уже не могут поддаваться контролю, если стресс затягивается слишком надолго.
Система обратной связи
В организме человека процессы регуляции осуществляются по принципу обратной отрицательной или положительной связи, и в целом этот механизм обусловливает организм как саморегулирующуюся и самовосстанавливающуюся систему.
При кратковременном стрессе повышение уровня глюкокортикоидов в крови обусловливает все те изменения в организме, которые направлены на сохранение гомеостаза.
По окончании стрессового воздействия глюкокортикоиды, повышенная концентрация которых уже не соответствует состоянию равновесия, начинают тормозить секрецию АКТГ – в этом и проявляется закон обратной биологической связи.
Во время дистресса такой связи не происходит: уровень глюкокортикоидов в крови остается повышенным. И этим обеспечивается механизм защиты от повреждения. Почему так происходит?
В гипоталамусе имеются рецепторы, связывающие глюкокортикоиды, и когда уровень гормонов в крови повышается (при стрессе), то они блокируют симпатическую нервную систему и весь каскад реакций, связанных с осью гипоталамус – гипофиз – кора надпочечников.
При длительном подъеме уровня глюкокортикоидов происходит снижение регулируемости рецепторов, что приводит к активации обеих систем. Глюкокортикоиды при длительном стрессе снижают чувствительность нейронов гипоталамуса к их тормозящему действию на секрецию КРГ.
Гипоталамус, несмотря на повышенный уровень глюкокортикоидов в крови, не прекращает синтезировать КРГ, которые в свою очередь активируют синтез АКТГ в гипофизе. АКТГ, попадая в надпочечники, стимулирует синтез глюкокортикоидов. В этом процессе механизм обратной связи прерывается.
Физиологические последствия такого явления, которое носит название «повышение порога чувствительности гипоталамуса к тормозящим эффектам глюкокортикоидов», очень велико.
Повышенный уровень катехоламинов и глюкокортикоидов при хроническом стрессе вызывает повреждение клеток, что ведет к развитию многих болезней, таких как атрофия мышц, артериальная гипертензия, резистентность к инсулину, аменорея, атеросклероз, остеопороз, вторичный иммунодефицит.
При старении, как и при стрессе, происходит повышение порога чувствительности гипоталамуса, что делает организм пожилого человека более чувствительным к стрессорным воздействиям и подверженным вышеназванным заболеваниям.
Не старость делает человека больным, а болезнь и болезни делают человека старым.
Ученые обнаружили, что у долгожителей система регуляции функций надпочечников работает на протяжении всей жизни на более высоком уровне, чем у остальных людей. Имеется положительная связь между массой надпочечников и продолжительностью жизни. Состояние этих желез является хорошим маркером биологического возраста.
Методология коррекции стресса
Коррекция негативных последствий стресса должна стать одной из составляющих программы предупреждения старения.
Для увеличения продолжительности жизни человека необходимы определенные условия, которые бы отвечали оптимуму жизнедеятельности организма. Условия жизни – это вся сфера жизни человека:
• общение человека с окружающим миром (природой, обществом), с самим собой;
• влияние факторов окружающей среды на организм;
• творчество, поведение, эмоции;
• условия труда и отдыха;
• питание;
• социальное состояние общества, его моральная атмосфера и т. д.
Наиболее правильно отражает всю сферу жизни человека такое понятие, как образ жизни.
Биологические возможности человека – не нечто неизменное, полученное по наследству. Они поддаются тренировке, изменяются в ходе жизни, контролируются самим человеком, зависят от его воли и свободного выбора. И такой выбор надо сделать в пользу оптимального образа жизни, того пути, где будут использоваться максимальные биологические возможности человека, что и определит его максимальную продолжительность жизни при данном генотипе.
Резкое снижение продолжительности жизни в нашей стране в современный период определяется хроническим стрессом ввиду неблагоприятной социально-экономической и психологической обстановки.
Подавленность, депрессия являются важными причинами ускоренного старения. Именно эмоциональное настроение через конкретные нейрогормональные механизмы сказывается на состоянии гомеостаза. Вот почему активный поиск способа изменения стрессовой ситуации так важен для каждого человека. Если невозможно устранить внешние источники стресса, необходимо использовать методы, позволяющие правильно анализировать жизненные ситуации, давая им реалистические оценки, обогащать свой поведенческий репертуар и, главное, верно расставлять акценты и приоритеты.
Что в данном случае предлагает медицина?
Обучение навыкам психосаморегуляции, к которым относятся нервно-мышечная релаксация, идеомоторная тренировка и аутотренинг – вот арсенал методов, который помог бы справиться с этой задачей. Психологическая коррекция стресса связана с устранением уже существующего дисбаланса. На практике это означает глубинную проработку индивидуальных проблем с помощью специальных тренингов, психотерапевтических консультаций, общеоздоровительных мероприятий, рефлексотерапии, суггестивных воздействий и др. Немаловажное значение имеет и правильное питание.
Стрессовые ситуации стимулируют аппетит и способствуют избыточному потреблению пищи. На фоне повышенного уровня глюкокортикоидов в крови это ведет к гиперинсулинемии, ожирению, гипертензии, атеросклерозу.
С древних времен для увеличения продолжительности жизни рекомендовались ограничения в количестве и структуре питания. Диеты с ограничением калорийности, или, так называемые голодные диеты, создают в организме ситуацию, которую можно охарактеризовать как дозированный стресс. Такой стресс приводит к активации всех функциональных систем: стимулируется клеточный обмен, происходит расщепление вредных метаболитов и т. д. Благодаря этому происходит тренировка адаптационного гомеостаза, профилактика старения, омоложение организма, продление жизни. В целом такая диета способствует повышению физической активности, интеллектуальных способностей, улучшению общего самочувствия. Дозированные голодные диеты – это метод воздействия на онтогенетические механизмы старения: на скорость развития возрастной патологии и главных болезней старения. Однако при этом нельзя забывать, что избыточность в плане ограничения диеты – это путь к снижению качества жизни.
Здесь необходимо найти золотую середину.
Как найти ее, эту середину, врачи не знают, а геронтологи еще не придумали.
Что рекомендуют врачи при использовании диет:
• строго придерживаться режима при любой диете;
• употреблять экологически чистые продукты;
• снизить калорийность, уменьшить употребление соли, сахара, жира, пряностей;
• уменьшить употребление мяса, отдавать предпочтение морепродуктам и вегетарианской пище;
• использовать натуральные продукты;
• включать в рацион пищу, содержащую пектины и клетчатку;
• сочетать голодания с методами очистки организма, физическими упражнениями, гидропроцедурами и закаливанием, психопрофилактикой и др.
Негативные последствия стресса очень велики и всем известны. Но можно ли обойтись без стрессов – ведь сама жизнь есть стресс! Мы не можем избежать тех нагрузок, эмоциональных встрясок, переживаний, из которых состоит наша жизнь. Сроки жизни укорачивает не сам стресс, а утрата приспособительных механизмов и истощение адаптационных возможностей, которые защищают организм от последствий хронического стресса.
В настоящее время для снижения негативных последствий стресса и предупреждения старения активно используется метод тренировки адаптационного гомеостаза. Сущность метода состоит в воздействии на организм раздражителей малой интенсивности, при котором происходит длительное и устойчивое повышение сопротивляемости к факторам внешней среды. В этом и состоит тренировка механизмов адаптации, увеличивается их мощность, растет адаптивность организма.
В медицине к таким оздоровительным факторам, которые используются в качестве тренировки адаптационного гомеостаза, повышающим резервные возможности организма, относятся психологические установки, дыхательные и физические упражнения, диеты, физиотерапевтические и гипоксические воздействия, лекарственные препараты.
Регулярные тренировки адаптационного гомеостаза приводят к формированию стереотипного ответа, который не оказывает повреждающего действия на организм человека. В ЦНС устанавливается так называемая физиологическая доминанта, следствием которой является устойчивость к стрессорным факторам, а также благоприятный психоэмоциональный фон. При наличии такой доминанты даже сильный стресс не вызывает резких колебаний в системе гомеостаза.
Кроме формирования доминанты, тренировка адаптационного гомеостаза выполняет важную роль в перепрограммировании адаптационных возможностей организма на решение новых задач, а также устраняет следы прошлых, негативных доминант, и тем самым разрывает тот порочный круг, который заставляет человека жить в постоянном хроническом стрессе.
Примечание. Моя оздоровительная программа «Адаптационная гимнастика» включает в себя все перечисленные элементы метода тренировки адаптационного гомеостаза. Само ее название говорит за себя, так главной целью этой программы является именно увеличение адаптационных возможностей организма.
Роль гипоталамуса в регуляции энергетического гомеостаза
Энергетическое обеспечение организма – это основа его существования. Вместе с тем, если оно выходит из-под контроля, то становится главной причиной ускоренного старения и формирования основных болезней человека. Регуляторный контроль обеспечивает непрерывную поставку тканям необходимых энергетических веществ между приемами пищи и голоданием. Метаболизм жиров и углеводов служит главным источником энергии для обеспечения физиологических функций организма.
Регуляция энергетического гомеостаза осуществляется целым комплексом нейрогуморальных факторов, действие которых направлено на стабилизацию массы человека. Регуляторные механизмы могут ограничивать массу тела двумя способами: или путем контроля количества энергии, поступающей с пищей в организм, или путем регулирования ее расходования (физическая активность, теплопродукция, теплоотдача). Первый способ тесно связан с механизмом формирования пищевого поведения, в основе которого лежит чувство голода. Именно голод является той мотивацией, которая направлена на устранение дискомфорта, связанного с недостатком питательных веществ в организме. В результате потребления пищи возникает общее ощущение, противоположное голоду, – насыщение.
В гипоталамусе, стволе мозга и периферической нервной системе имеются проводящие пути, которые регулируют прием пищи. Именно гипоталамус является интегративным центром регуляции энергетического гомеостаза. В его латеральной зоне обнаружены участки, стимуляция которых вызывает чувство голода, а их разрушение – отказ от приема пищи. Это – центр голода.
В другом участке мозга располагается центр насыщения. Эти области гипоталамуса составляют пищевой центр.
Концентрация глюкозы в крови играет центральную роль в пищевом поведении. Ее уровень отражает энергетическую потребность организма.
В центре голода гипоталамуса имеются нейроны, рецепторы которых ингибируются при увеличении уровня глюкозы в крови и активируются при снижении ее уровня. В последнем случае возникает чувство голода.
Глюкоза – основной источник энергии, особенно для тех тканей, которые целиком зависят от гликолиза для получения энергии и требуют непрерывной подачи глюкозы каждую секунду. Это мозг, эритроциты, хрусталик глаза, паренхима почки, работающая мышца. У взрослого человека потребность в глюкозе составляет минимум 190 г в день (около 150 г для мозга и 40 г для других тканей).
Поджелудочной железе отводится ведущая роль в регуляции гомеостаза глюкозы. Она выделяет два гормона: инсулин и глюкагон.
Инсулин служит в качестве переносчика глюкозы, калия и аминокислот через мембрану клетки в цитоплазму. В жировой ткани он усиливает транспорт глюкозы и повышает гликолиз (окисление глюкозы), скорость синтеза жирных кислот и ингибирует липолиз. Липолиз – расщепление глицеридов (собственно, жиров), в результате чего образуются жирные кислоты и глицерин. Этот процесс активирует адреналин.
Инсулин является анаболическим гормоном: повышает синтез ферментов, ДНК, белков. В крови он снижает концентрацию глюкозы и жирных кислот.
Глюкагон, в противоположность инсулину, повышает уровень сахара в крови, усиливая выход глюкозы из печени, активируя процесс гликогенолиза. Глюкагон совместно с глюкозой активирует гликонеогенез, то есть синтезирует гликоген из белков. Этот процесс является физиологически важным, поскольку глюкоза абсолютно необходима для клеток. Вместе с тем благодаря этому процессу не обязательно, чтобы глюкоза входила в состав пищи – в случае отсутствия в рационе углеводов в качестве предшественников гликогена и глюкозы могут выступать белки.
Имеются данные, которые показывают, что в регуляции секреции поджелудочной железы принимает участие гипоталамус.
Энергетический баланс у человека поддерживается при условии соответствия поступления энергии с пищей и ее расхода на мышечную работу, химические процессы (рост, восстановление тканей и т. д.) и потерю тепла. При избыточном питании образуются жировые отложения, и масса тела растет; при недостаточном питании жировые отложения расходуются, и масса тела снижается. Обычно человек приспосабливает потребление пищи к текущим потребностям (физическая активность, климатические условия и т. п.), что предполагает наличие в этом процессе какого-то регулятора.
Роль регулятора потребления пищи выполняет гипоталамус. Он контролирует массу тела с помощью двух регуляторных механизмов. Один из них является кратковременным регулятором потребления пищи, с помощью которого определяется количество энергетических веществ в каждый момент приема пищи. Действие этого регулятора основано на ощущениях голода и насыщения, о чем уже говорилось выше.
Второй регулятор потребления пищи долговременный. Его деятельность направлена на корректировку содержания жиров посредством контроля уровня гормонов (инсулина и лептина). Концентрация этих гормонов в крови коррелирует с количеством жировой ткани в организме человека. Если возрастает количество жиров, то увеличиваются и уровни инсулина и лептина, которые, воздействуя на гипоталамус, приводят к снижению потребления пищи и соответственно массы жировой ткани.
При старении организма чувствительность центра насыщения в гипоталамусе к повышению уровня глюкозы снижается. В крови накапливается избыток глюкозы, которая с годами хуже усваивается мышечной тканью, и ее избыток депонируется в жировой ткани.
Более 800 000 книг и аудиокниг! 📚
Получи 2 месяца Литрес Подписки в подарок и наслаждайся неограниченным чтением
ПОЛУЧИТЬ ПОДАРОКДанный текст является ознакомительным фрагментом.
Читайте также
Защитные механизмы
Защитные механизмы Чем больше мы привязаны к какой-то эмоциональной реакции, тем с большей вероятностью будем искать в каждом неоднозначном сигнале ее подтверждение. Любое явное противоречие мы либо не заметим, либо логически объясним, придав ему более гибкую форму.
Законы Старения
Законы Старения Каждый стареет. С того самого дня как родился, ты начал и стареть – каждое мгновение, каждый день. Детство течет, молодость течет – только старость никогда не уходит, потому что обрывается! Это уникальное качество старости – она приносит предельный отдых.
Современные теории старения
Современные теории старения Геронтология – наука, изучающая закономерности старения живых существ, в том числе человека, и старческий возраст.Современная геронтология – междисциплинарная наука, в состав которой входят биология старения, клиническая гериатрия,
ПРОБЛЕМА СТАРЕНИЯ
ПРОБЛЕМА СТАРЕНИЯ П.МАНН«Русский голос» Воскресенье, 14 апреля, 1935Когда были опубликованы работы Мечникова, казалось, что проблема продления человеческой жизни решена. Согласно его взглядам, преждевременное, сопровождающееся болезнями старение и смерть являются
АГРЕГАТЫ, МЕХАНИЗМЫ
АГРЕГАТЫ, МЕХАНИЗМЫ 1. ДВИГАТЕЛЬ — период активности, силы, продуктивной энергии; новое дело, которое потребует значительных энергетических затрат; состояние вашего сердца.2. КАБЕЛЬ (СОЕДИНИТЕЛЬНЫЙ) — подключённость к новым энергетическим источникам (напр. в результате
Механика старения
Механика старения Мы с вами – не только светящиеся существа, излучающие энергию. В своей материальной основе мы своего рода капли одушевленной воды. Старый человек представляет собой иссушенную каплю, если, конечно, он не заплыл жиром. Организм стареет, когда вода
Процесс старения идет вспять
Процесс старения идет вспять Мне часто приходят письма, которые сводятся к одному и тому же: «Возможно ли с помощью Трансерфинга сохранить молодость, обрести здоровье, улучшить свою внешность, повысить жизненный тонус? Что вы сами делаете в этом направлении? Чем
Причины старения и увядания
Причины старения и увядания Всю человеческую жизнь можно выразить как последовательные рождение, взросление, зрелость, старость и смерть. Но что же является причиной старения и увядания? Получив ответ на этот вопрос, можно будет найти способ отсрочить наступление
Физические аспекты старения
Физические аспекты старения Ниже перечислены некоторые физиологические изменения, связанные со старением, и даны намеки на некоторые из переживаний страны грез, сопровождающих эти симптомы. Психологические переживания носят всего лишь предположительный характер; они
Определение старения
Определение старения Такие термины, как жизнь, любовь, природа, и старение, указывают на многомерный опыт. Составляющая старения, принадлежащая к общепринятой реальности, обычно относится к износу нашего физического тела. Наша внешность меняется: мы становимся меньше
Работа с симптомами старения
Работа с симптомами старения В дополнение к работе с общим опытом старения, некоторым людям, может быть, весьма полезно работать с конкретными симптомами старости. Для этого удобно выявить конкретный симптом, который кажется вам связанным со старением. Выберите момент и
Фактор старения
Фактор старения Из предыдущих глав нам известно, что клетки восстанавливаются и ремонтируют сами себя потому, что код ДНК постоянно разделяется и удваивается, воссоздавая жизнь. В процессе митоза ядро клетки делится. Если бы не случайные аварии, этот процесс репликации